Farmaci equivalenti
Un farmaco equivalente è un medicinale che contiene la stessa quantità di principio attivo e presenta la stessa biodisponibilità di un farmaco di marca con brevetto scaduto.
I medicinali di marca sono protetti da brevetto per alcuni anni, per aiutare l’azienda che ne ha sostenuto a lungo le spese di ricerca e poi di lancio. Alla fine di questo periodo “protetto”, il farmaco può essere prodotto da altre case farmaceutiche e venduto a prezzi più facilmente accessibili.
Generico o Equivalente



La bio equivalenza
Due prodotti medicinali si dicono bioequivalenti se le loro biodisponibilità, cioè la quantità e la velocità con le quali il principio attivo è rilasciato ed è reso disponibile in circolo, sono equivalenti.
In pratica il concetto di medicinale generico si basa sull’assunzione che, in uno stesso soggetto, un uguale andamento temporale della concentrazione plasmatica di sostanza attiva comporti un’uguale concentrazione di sostanza nel sito di azione e, pertanto, un’uguale effetto terapeutico.
Per questa ragione la concessione da parte dell’Agenzia Italiana del Farmaco (AIFA) di un’Autorizzazione all’Immissione in Commercio (AIC) di un medicinale generico si basa sulla dimostrazione della qualità del prodotto e della sua bioequivalenza rispetto al medicinale originatore.
Cosa dice la legge
La definizione della nozione di farmaco generico è contenuta nell’Articolo 10 Comma 5 Lettera b del Decreto Legislativo 219 del 2006, che così recita in proposito: “medicinale generico: un medicinale che ha la stessa composizione qualitativa e quantitativa di sostanze attive e la stessa forma farmaceutica del medicinale di riferimento nonché una bioequivalenza con il medicinale di riferimento dimostrata da studi appropriati di biodisponibilità”.
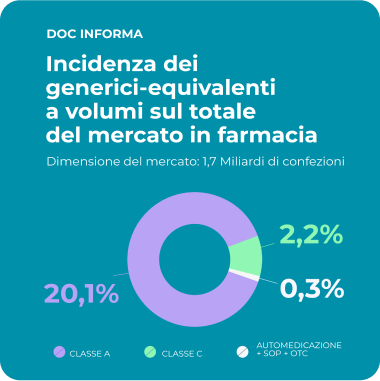
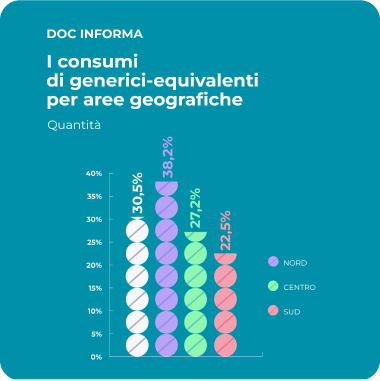
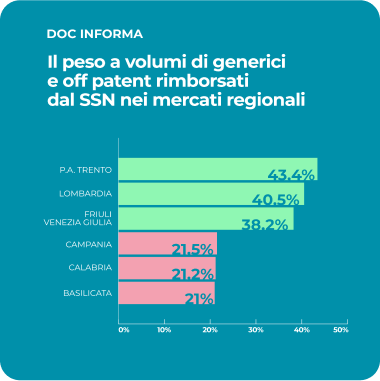
Il valore sociale del farmaco equivalente
Perchè costa meno
Il farmaco generico costa meno rispetto all’originatore perché sono già stati recuperati, durante il periodo di monopolio concesso dal brevetto, gli investimenti fatti in ricerca.
È noto che per dimostrare l’efficacia e la sicurezza terapeutica di un nuovo farmaco è necessario sperimentarlo su centinaia o addirittura migliaia di soggetti. Tale sperimentazione richiede mesi e ha costi elevati.
L’azienda che mette in commercio un medicinale generico, invece, è esentata dalla dimostrazione dell’efficacia terapeutica in quanto, se il principio attivo raggiunge nel sangue gli stessi livelli ottenuti dal medicinale originatore (se è cioè bioequivalente a questo), presenta anche la stessa efficacia terapeutica. Dimostrare la bioequivalenza rispetto ad un farmaco di efficacia e sicurezza note richiede tempi e costi molto minori, per cui il farmaco generico può essere posto in commercio ad un prezzo inferiore.
